andere Kfz-Technik
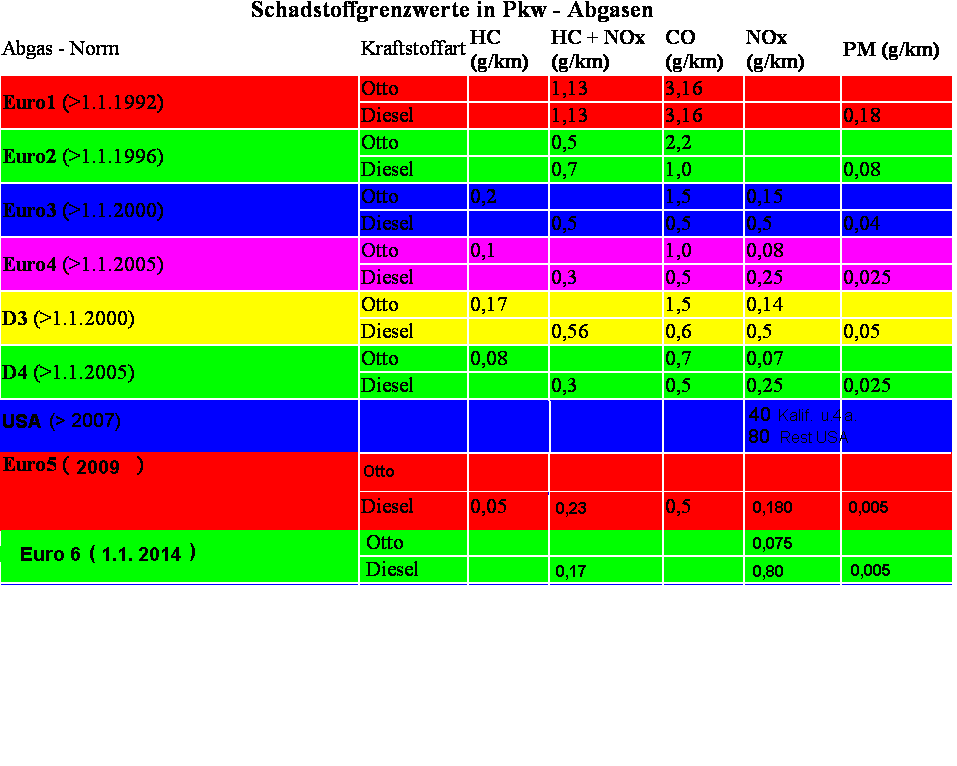
Schadstoffgrenzwerte in Abgasen
zuletzt bearbeitet am 08.08.2007
gesetzliche Grenzwerte
Fahrzyklus
Berechnung der Abgaszusammensetzung
grafische Darstellung der Ergebnisse
CO2-Emissionen- Flottenverbrauch
|
Autoelektrik (Startseite) andere Kfz-TechnikSchadstoffgrenzwerte in Abgasenzuletzt bearbeitet am 08.08.2007 |

|
gesetzliche Grenzwerte Fahrzyklus Berechnung der Abgaszusammensetzung grafische Darstellung der Ergebnisse CO2-Emissionen- Flottenverbrauch |
Seitenanfang |
gesetzliche Grenzwerte |
Fahrzyklus |
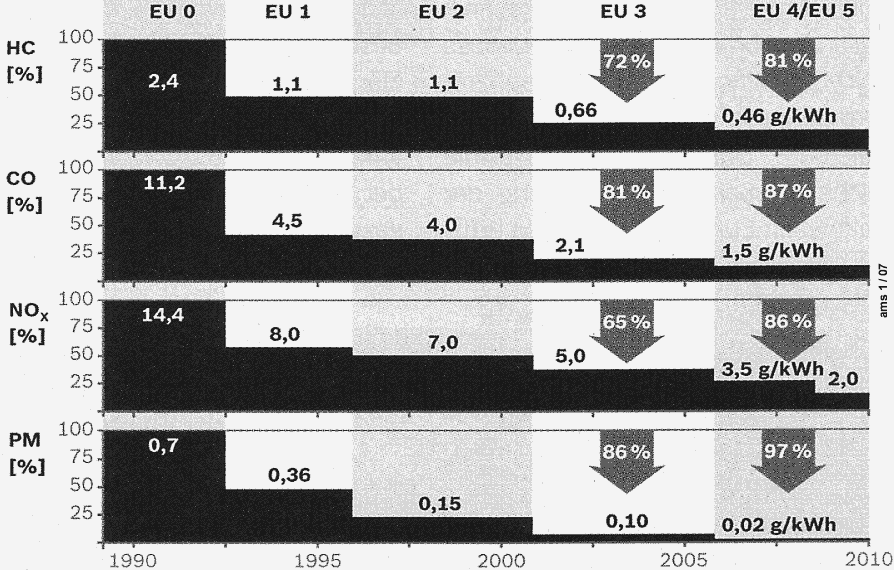
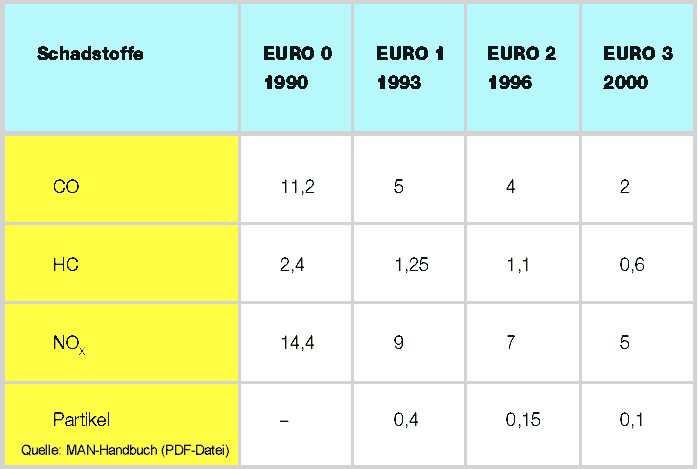
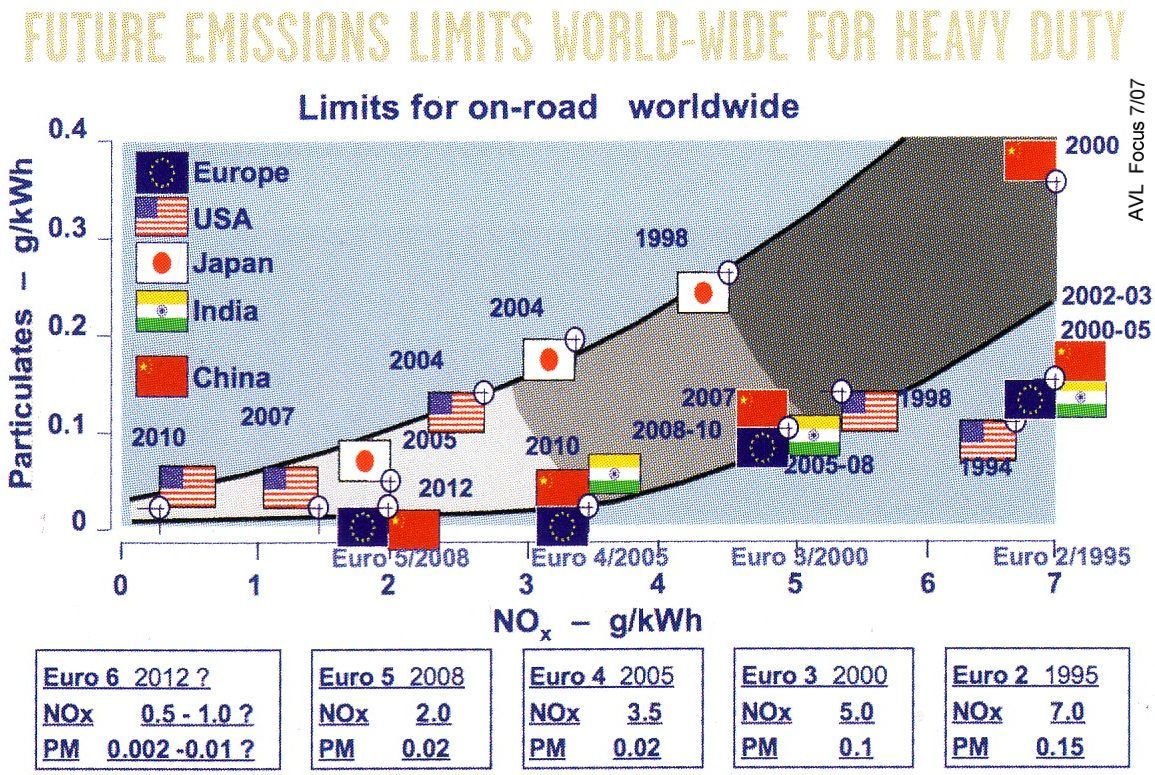
gesetzliche Grenzwerte |
Fahrzyklus |
Berechnung der Abgaszusammensetzung |
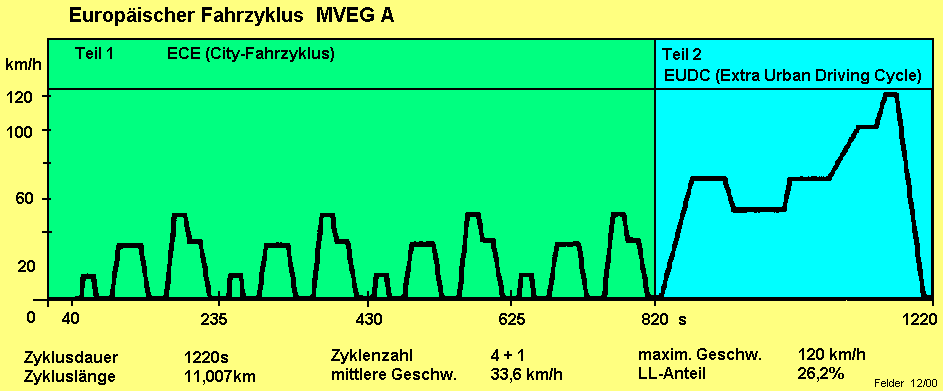
Fahrzyklus |
Berechnung der Abgaszusammensetzung |
grafische Darstellung der Ergebnisse |
Die Gesamtabgasmasse dieses Pkw lässt sich wie folgt abschätzen: |
||
|---|---|---|
| Kraftstoffverbrauch | 5 l / 100km | |
| Lambda | 1 | 14,7kg Luft für 1kg Benzin |
| Dichte des Benzins | 0,75 kg / l | |
| Kraftstoffverbrauch | 3,75 kg / 100km | |
| Gesamtluftverbrauch | 3,75 * 14,7 kg | 55,125 kg / 100 km |
| Gesamtmassenumsatz im Motor | 58,875 kg / 100km | Gemisch wird angesaugt |
| Gesamtabgasmasse | 58,875 kg / 100km | Im Motor gehen keine Teilchen verloren, sie werden nur chemisch "umsortiert". |
| Gesamtabgasmasse | 589 g / km | |
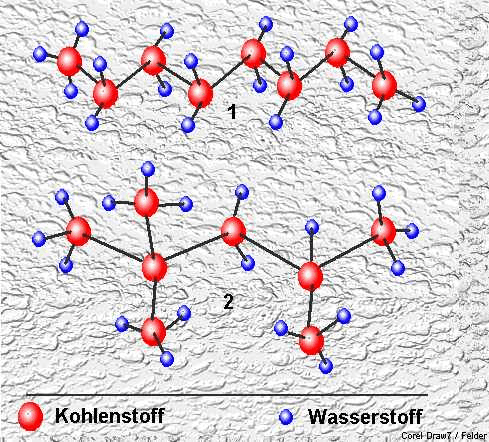 Zur Vereinfachung sei folgendes bedacht:
Zur Vereinfachung sei folgendes bedacht: Berechnung der Massen der an der Verbrennung beteiligten Teilchen |
||||
|---|---|---|---|---|
| Zeichen | Formel | Berechnung | Ergebnis (gerundet) | Erläuterung |
| u | 1,66 * 10 -27kg | 1 u ist definiert als ein 12. der Masse des Kohlenstoffatoms, das aus genau 6 Elektronen, 6 Neutonen und 6 Protonen besteht. Daten zur Atomphysik | ||
| mH2 | 2 (atomare Masseneinheiten) | = relative Masse des Wasserstoffmoleküls. Das Wasserstoffmolkül besteht aus 2 Atomen Wasserstoff. Relative Atommasse von Wasserstoff siehe Periodensystem | ||
| MH2 | M H2 = m H2 * u | = 2 * u | =3,32 * 10 -27kg | = absolute Masse des Wasserstoffmoleküls (ein Wasserstoffatom wiegt halb so viel.) Wasserstoff kommt in der Natur als 2-atomiges Molekül gasförmig vor. |
| mC | 1 * 12 | 12 (atomare Masseneinheiten) | = relative Masse des Kohlenstoffatoms. Ein spezielles Kohlenstoffatom hat genau die 12-fache atomare Masseneinheit, so hat man diese Einheit definiert. Kohlenstoff gibt es atomar, also einzeln.Relative Atommasse von Kohlenstoff siehe Periodensystem | |
| MC | C = mC * u | = 12 * u | = 19,92 * 10 -27kg | = absolute Masse des Kohlenstoffatoms |
| mO2 | , | 2 * 16 | 32 (atomare Masseneinheiten) | = relative Masse des Sauerstoffmoleküls. Bis auf die Edelgase liegen die meisten anderen Gase als 2-atomige Moleküle vor. Relative Atommasse von Sauerstoff siehe Periodensystem |
| MO2 | MO2 = mO2 * u | = 32 * u | 53,12 * 10 -27kg | = absolute Masse des Sauerstoffmoleküls |
| mN2 | = 2 * 14 | = 28 (atomare Masseneinheiten) | = relative Masse des Stickstoffmoleküls.Das Stickstoffmolkül besteht aus 2 Atomen Stickstoff. Relative Atommasse von Stickstoff siehe Periodensystem | |
| MN2 | MN2 = mN2 * u | =28 * u | =46,48 * 10 -27kg | = absolute Masse des Stickstoffmoleküls |
| mH2O | = 2 *1 + 1* 16 | = 18 (atomare Masseneinheiten) | = relative Masse des Wassermoleküls. Diese rel. Masse setzt sich aus den rel. Massen der Einzelatome zusammen | |
| MH2O | MH2O = mH2O * u | = 18 * u | = 29,88 * 10 -27kg | = absolute Masse des Wassermoleküls. Diese abs. Masse setzt sich aus den abs. Massen der Einzelatome zusammen |
| mCO2 | = 1 * 12 + 2 *16 | = 44 (atomare Masseneinheiten) | = relative Masse des Kohlendioxidmoleküls. Diese rel. Masse setzt sich aus den rel. Massen der Einzelatome zusammen | |
| MCO2 | MCO2 = mCO2 * u | = 44 * u | = 73,04 * 10 -27kg | = absolute Masse des Kohlendioxidmoleküls. Diese abs. Masse setzt sich aus den abs. Massen der Einzelatome zusammen |
| mC8H18 | , | = 8 * 12 + 18 * 1 | = 114 (atomare Masseneinheiten) | = relative Masse des Oktanmoleküls. Diese rel. Masse setzt sich aus den rel. Massen der Einzelatome zusammen |
| MC8H18 | MC8H18 = mC8H18 * u | = 114 * u | = 189,27 * 10 -27kg | = absolute Masse des Oktanmoleküls. Diese abs. Masse setzt sich aus den abs. Massen der Einzelatome zusammen |
| NL | aus Tabellenbuch | = 2,69 * 10 25 / m 3 | Diese Loschmidt Zahl gibt an, wieviele Teilchen in einem m 3 idealen Gas bei 0°C und 1bar Druck sind.. Z.B. sind in einem m 3 Abgas hinter dem Auspuff (1bar, abgekühlt) insgesamt etwa 2,69 * 10 25 unterschiedliche Moleküle. | |
In dieser Tabelle sind die zur weiteren Berechnung erforderlichen Daten zusammengestellt. |
||||

weitere Berechnungen zum Luftverbrauch (Pkw, Otto-Motor, 5l/100km) |
||||
|---|---|---|---|---|
| Größe | Formel | Berechnung | Ergebnis (gerundet) | Erläuterung |
| Gemischzusammen- setzung (Volumen) rvg | rvg = VO2 / VC8H18 | = 25 / 2 | 12,5 | Für die ideale Verbrennung von Oktan mit Sauerstoff benötigt man für je 2 Oktanmoleküle 25 Sauerstoffmoleküle. Dieses Teilchenverhältnis ist dann auch gleich dem Volumenverhältnis von Oktan zu Sauerstoff, falls beide Stoffe gasförmig bei gleichem Druck und gleicher Temperatur vorliegen. Dies nennt man stöchiometrisches Verhältnis. |
| Gemischzusammen- setzung (Masse) rmg | rmg =mO2)*25 / mC8H18) *2 | = 53,12 * 10 -27kg*25 / 189,27 * 10 -27kg*2 | 3,51 | Das entspricht Lambda = 1 für das Oktan - Sauerstoff - Gemisch. Um 1kg Oktan zu verbrennen, benötigt man genau 3,51kg Sauerstoff. |
| Luftzusammensetzung (Volumen) rvl | rvl = VN2 / VO2 | siehe Erläuterung | 4 / 1 = 4 | hier wird vereinfachend angenommen, dass Luft zu 80 Vol% aus Stickstoff und zu 20 Vol% aus Sauerstoff besteht. Dieses Verhältnis bedeutet, dass der Motor mit jedem Sauerstoffmolekül auch 4 Stickstoffmoleküle ansaugt. |
| Luftzusammensetzung (Masse) rml | rml = rvl * mN2 / mO2 | =4 * 46,48 * 10 -27kg / 53,12 * 10 -27kg | 3,5 | Das Massenverhältnis (Stickstoff / Sauerstoff) der Luft ist 3,5 / 1. Es ist nicht 4 /1 , weil jedes Stickstoffteilchen etwas leichter ist als ein Sauerstoffteilchen. |
| Oktanmasse mOK | mOK = VOK * rhoOK | = 5l * 0,75 kg/l | 3,5kg | 3,5 kg Oktan benötigt der Motor auf 100km |
| Gesamtsauerstoff- verbrauch mVO2 | mVO2 = mOK * rmg | = 3,5kg * 3,51 | 12,29kg | Auf 100 km verbraucht der Motor also 12,29 kg Sauerstoff. (zufällig sind die beiden Zahlenwerte in der Rechnung fast gleich.) |
| Gesamtstickstoff- verbrauch mN2 | mN2 = mO2 * rml | = 12,29kg * 3,5 | 43,02kg | Wenn der Motor 12,29kg Sauerstoff ansaugt, saugt er in der Luft gleichzeitig 43,02kg Stickstoff mit an. |
| Gesamtluft- verbrauch mL | mL = mO2 + mN2 | =12,29kg + 43,02kg | 55,31kg | 55,31kg Luft hat der Motor auf 100km Strecke angesaugt Die gesamte Luftmasse ist gleich der Sauerstoffmasse und der Stickstoffmasse |
| stöchiometr. Luft- Kraftstoffgemisch ri | ri=mL / mOK | = 55,31kg / 3,5kg | = 15,8 | Um 1 kg Oktan sauber zu verbrennen benötigt man genau 15,8 kg Luft. Dies entspricht Lambda = 1 für die gegebenen Bedingungen: reines Oktan, angenommene Luftzusammensetzung. Für das Kohlenwasserstoffgemisch BENZIN und die tatsächliche Luftzusammensetzung ergibt sich der bekannte Wert von 14,7kg Luft für 1kg Benzin. |
Der Motor verbraucht auf 100km 3,5kg Oktan, 12,29kg Sauerstoff und 43,02kg Stickstoff ( = 58,81kg Gemisch) |
||||
Berechnungen zur Abgaszusammensetzung (Pkw, Otto-Motor, 5l Oktan / 100km) |
|||||
|---|---|---|---|---|---|
2 C8H18 + 25 O2 + 100 N2 -> 16 CO2 + 18 H2O + 100 N2Dies ist der Umsatz im Motor, wenn Oktan mit Luft ideal verbrannt wird |
|||||
| Größe | Formel | Berechnung | Ergebnis (gerundet) | Erläuterung | |
| Gesamtmasse Abgas Ma | Ma = ML + MOK |
= 3,5kg + 55,31kg | 58,81kg | Die Masse, die der Motor ansaugt, muss er auch wieder ausstoßen. Im Motor werden die Teilchen nur chemisch neu "sortiert", es geht aber weder ein Atom verloren, noch wird ein neues erzeugt. Mok= Oktanmasse | |
| Abgaszusammensetzung (Volumen) rva | rva =VCO2 / VH2O / VN2 | siehe Reaktionsgleichung | 16 / 18 / 100 | Wenn zwei Oktanmoleküle mit 25 Sauerstoffmolekülen verbrannt werden entstehen 18 Wassermoleküle und 16 Kohlendioxidmoleküle.Die 100 Stickstoffmoleküle, die gleichzeitig mit den 25 Sauerstoffmolekülen angesaugt werden, verlassen den Motor "unverdaut". Dieses Teilchenzahlenverhältnis ist gleich dem Volumenverhältnis, da in gleichen Volumina bei gleichem Druck und gleicher Temperatur gleiche Teilchenzahlen zu finden sind, egal welche Molekülsorte. | |
| Stickstoffmasse MN2a | siehe Tabelle vorher | 43,02kg | Im Idealfall bleibt der in der Luft enthaltene Stickstoff unbeteiligt.Tatsächlich entstehen einige Stickoxidmoleküle, die hier nicht berücksichtigt werden, so dass gilt MN2a = MN2. | ||
| Restabgasmasse Mra | Mra = Ma - MN2 | = 58,81 kg - 43,02 kg | 15,79 kg | Diese Masse entspricht auch der Summe aus Kraftstoffmasse und Sauerstoffmasse. Soviel wiegt der auf 100km Strecke ausgeblasene Wasserdampf und das Kohlendioxid zusammen. | |
| Restabgaszusammensetzung (Masse) rmra | rmra = VH2 / VCO2 * (mH2O / mCO2) | = 18 / 16 * 18 / 44 | 1 / 2,17 | Auf jedes kg Wasserdampf im Abgas kommen 2,17 kg Kohlendioxid. In der Berechnung wurden die relativen Molekülmassen anstelle der absoluten Werte eingetragen. | |
| Wasserdampfmasse im Abgas MH2Oa | MH2Oara * 1 / 3,17 | = 15,79kg * 1 / 3,17 | 4,98kg | Auf 100 km pustet das Fahrzeug 4,98 kg Wasserdampf in die Luft. | |
| Kohlendioxidmasse im Abgas MCO2a | MCO2a = Mra * 2,17 / 3,17 | = 15,79kg * 2,17 /3,17 | 10,81kg | Auf 100 km bläst der Motor auch 10,81 kg Kohlendioxid in die Umwelt. (Probe: 4,89kg +10,81kg = 15,79kg) | |
| Abgaszusammensetzung (Masse) rMa | rMa = MCO2a / MH2Oa / MN2a | 10,81kg / 4,98kg / 43,02kg | Massenverhältnisse im Abgas MCO2a / MH2Oa / MN2a) | ||
Nun ist vom Abgas, das pro 100km Wegstrecke produziert wird, bekannt:
Zu ermitteln sind noch das Gesamtvolumen und die Teilvolumina der Einzelgase des Abgases! |
|||||
| Wasser | Anzahl | NH2Oa =MH2Oa / MH2O | = 4,98kg / 29,88 * 10-27kg | 1,66 * 10 26 | Anzahl der Wassermoleküle im Abgas auf 100km. (= Gesamtmasse von Wasserdampf im Abgas / Masse eines Wassermoleküls) |
| Volumen | VH2Oa =NH2Oa / NL | =1,66 * 1026 / 2,69 * 1025 / m3 | 6,17 m 3 | 6,17 m3 Wasserdampf stößt der Motor auf 100km Strecke aus. | |
| Kohlendioxid | Anzahl | NCO2a =MCO2a / MCO2 | = 10,91kg / 73,04 * 10-27kg | 1,49 * 10 26 | Anzahl der Kohlendioxidmoleküle im Abgas auf 100km (= Gesamtmasse von Kohlendioxid im Abgas / Masse eines Kohlendioxidmoleküls) |
| Volumen | VCO2a =NCO2a / NL | =1,49 * 1026 / 2,69 * 10 25 / m 3 | 5,54 m 3 | 5,54 m 3 Wasserdampf stößt der Motor auf 100km Strecke aus. | |
| Stickstoff | Anzahl | NN2a =MN2a / MN2 | = 43,02kg / 46,48 * 10-27kg | 9,25 * 10 26 | Anzahl der Stickstoffmoleküle im Abgas auf 100km (= Gesamtmasse von Stickstoff im Abgas / Masse eines Stickstoffmoleküls) |
| Volumen | VN2a =NN2a / NL | =9,25 * 1026 / 2,69 * 10 25 / m 3 | 34,34 m 3 | 34,34 m 3 Stickstoff stößt der Motor auf 100km Strecke aus. (genau so viel, wie er angesaugt hat) | |
| Abgas gesamt | Anzahl | NA = NH2Oa + NCO2a + NN2a | = 1,66 * 10 26 + 1,49 * 10 26 + 9,25 * 10 26 | 12,4 * 10 26 | Anzahl aller Moleküle im Abgas auf 100km (Summe aus ...) |
| Volumen | VA = VH2Oa + VCO2a + VN2a | = 6,17 m3 + 5,54 m 3 + 34,34 m 3 | 46,05 m 3 | Gesamtabgasvolumen auf 100 km (Summe aus ...) | |
Nun ist vom Abgas auch bekannt :
Es fehlt noch das Gesamtvolumen des Abgases? |
|||||
Berechnung der Abgaszusammensetzung |
grafische Darstellung der Ergebnisse |
Seitenende |

| 
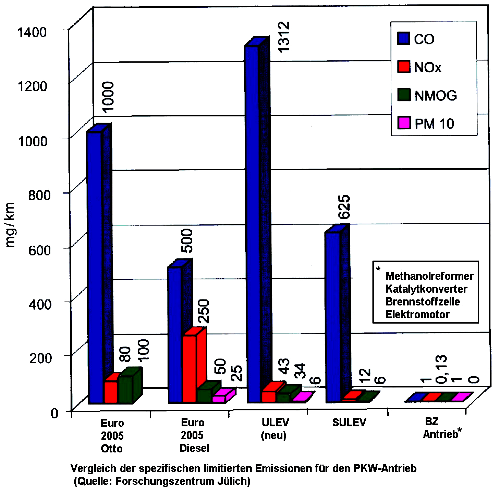
| Abgasproduktion eines Benzinmotors auf 100km StreckeDie errechneten Ergebnisse sind hier grafisch dargestellt. Die Massenverhältnisse (links) unterscheiden sich geringfügig von den Volumenverhältnissen. Deutlich ist erkennbar, dass der an der Verbrennung (fast) unbeteiligte Stickstoff den weitaus größten Anteil im Abgas ausmacht, gefolgt vom völlig harmlosen Wasserdampf. Den drittgrößten Anteil hat das Kohlendioxid. Dieses Gas ist zwar ungiftig und spielt im Stoffwechselkreislauf der Natur eine wichtige Rolle (Menschen und Tiere atmen es aus, die Pflanzen benötigen Kohlendioxid zum Wachstum und zur Sauerstoffproduktion), bildet aber den größten vom Menschen verursachten Anteil am Treibhauseffekt und damit an der stetigen Klimaerwärmung. Die Fortsetzungspunkte in den Abbildungen meinen z.B. unverbrannten Sauerstoff, Schwefeloxide und andere AbgasbestandteileMit einer weiteren Absenkung des orange eingezeichneten Abgasanteils ist mit den Euro4 / D4 Normen beschlossen, die ab 2005 für Neufahrzeuge verbindlich werden. Die Verringerung des CO2 Ausstoßes haben die Kfz-Hersteller versprochen (Senkung des Flottenverbrauchs). Schwefelärmerer Kraftstoff wird auch in Deutschland inzwischen angeboten. |
grafische Darstellung der Ergebnisse |
CO2-Emmisionen / Flottenverbrauch |
Seitenende |
 |
Quickstart |  |
 |
 |
 |
 |
Seite:180 |