Starterbatterien
Lade-/Entladeprozesse
zuletzt bearbeitet am 26. 10. 2002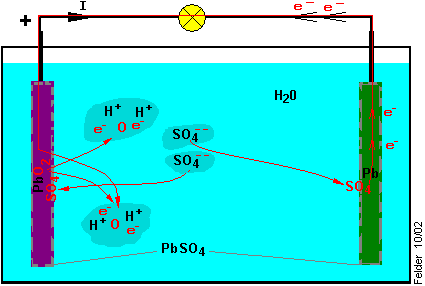
geladen
Entladung
entladen
Ladung
|
Autoelektrik (Startseite) StarterbatterienLade-/Entladeprozessezuletzt bearbeitet am 26. 10. 2002 |

|
geladen Entladung entladen Ladung |
 Im geladenen Zustand besteht also das aktive Material der Plusplatten aus Bleidioxid , das der Minusplatten aus reinem Blei.
Im geladenen Zustand besteht also das aktive Material der Plusplatten aus Bleidioxid , das der Minusplatten aus reinem Blei. Bei der Entladung wird der Akku mit einem Verbraucher belastet. Dabei ist der Akku die Energiequelle, der Verbraucher die Energiesenke und Strom (I) fließt von der
Plusklemme des Akkus über die Leitung, durch den Verbraucher, über die Masseverbindung zur Minusklemme des Akkus. Der Stromkreis schließt sich über die Innereien des Akkus.
Bei der Entladung wird der Akku mit einem Verbraucher belastet. Dabei ist der Akku die Energiequelle, der Verbraucher die Energiesenke und Strom (I) fließt von der
Plusklemme des Akkus über die Leitung, durch den Verbraucher, über die Masseverbindung zur Minusklemme des Akkus. Der Stromkreis schließt sich über die Innereien des Akkus.

|
| |||||
|
Chemische Reaktionsgleichungen sind leicht zu prüfen, wenn man folgende Spielregeln beachtet:
| ||||||
 Im entladenen Zustand haben sowohl die Plus- als auch die Minusplatten einen guten Anteil von PbSO2 (Bleisulfat), bestehen aber längst nicht vollständig aus diesem Zeug.
Bestünden beide Platten vollständig aus demselben Material, so gäbe es an den Polklemmen überhaupt keine Spannung mehr (siehe elektrochemische Spannungsreihe).
Im entladenen Zustand haben sowohl die Plus- als auch die Minusplatten einen guten Anteil von PbSO2 (Bleisulfat), bestehen aber längst nicht vollständig aus diesem Zeug.
Bestünden beide Platten vollständig aus demselben Material, so gäbe es an den Polklemmen überhaupt keine Spannung mehr (siehe elektrochemische Spannungsreihe). |
Im Gegensatz zu den Primärelementen ist beim Akku der elektrochemische Prozess der Entladung jedoch reversibel (umkehrbar).
Schließt man den entladenen Akku also an ein Ladegerät oder arbeitet der Generator im Kfz während der Fahrt, so wird der Akku wieder geladen.
Im Prinzip laufen dabei die gleichen Prozesse ab wie bei der Ladung, nur in entgegengesetzter Richtung. Beim Laden wirkt der Akku daher als Verbraucher (Energiesenke) und wird von einer externen Spannungsquelle gespeist. | ||||||

|
| |||||
 Damit ist der Zyklus beendet und der Akku hat wieder seinen Ausgangszustand erreicht. Diese Ladezyklen wiederholen sich mit jedem Start- / Fahr- Vorgang sowie bei
günstigen / ungünstigen Betriebszuständen des Fahrzeugs:
Damit ist der Zyklus beendet und der Akku hat wieder seinen Ausgangszustand erreicht. Diese Ladezyklen wiederholen sich mit jedem Start- / Fahr- Vorgang sowie bei
günstigen / ungünstigen Betriebszuständen des Fahrzeugs:
 |
Quickstart |  |
 |
 |
 |
 |
Seite:83 |