Automobilelektrik
Starterbatterien
Galvanische Elemente

Galvanische Elemente
elektrochemische Spannungsreihe
|
AutomobilelektrikStarterbatterienGalvanische Elemente |

|
Galvanische Elemente elektrochemische Spannungsreihe |
Seitenanfang |
Galvanische Elemente |
Elektrochemische Spannungsreihe |

|  |
Elektroden sind diejenigen Teile von festen elektrischen Leitern, die dem Übergang des Stroms in ein anderes Medium dienen.
Die mit dem Pluspol der Spannungsquelle verbundene Elektrode nennt man Anode, die andere Katode. In den Bildern sind also die beiden Metallstäbe in der Apfelsine bzw. im Elektrolyt die Elektroden. Mittelelektrode und Masseelektrode gibt´s an der Zündkerze. Beim Schweißen benutzt man Elektroden und in der Medizin z.B. zur Aufnahme von Herz - oder Gehirnspannungen. |
| Steckt man in eine Orange einen Nagel und einen Kupferdraht, so kann man an deren Enden eine Spannung messen. | Ein Glasgefäß (Isolator) ist mit einem Elektrolyt gefüllt. Taucht man zwei verschiedene Leiter (Elektroden) hinein, so ergibt sich zwischen den Elektroden die Elektrochemische Spannung. |
Elektrolyte sind elektrisch leitfähige Flüssigkeiten, z.B. Salzwasser oder verdünnte Säuren. Ladungsträger im Elektrolyt
sind Ionen, die sich in der Flüssigkeit von einer Elektrode zur anderen bewegen. Die Ionen wiederum entstehen durch Dissoziation
(= Zerlegung) von Molekülen in mehrere Teile.
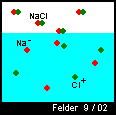 Z.B. zerfällt Kochsalz (NaCl) im Wasser in Na- und Cl+, wobei das Chlor sein
einziges Elektron der äußeren Schale an das Na- Atom abgibt, das dann eine Edelgaskonfiguration auf seiner äußeren Schale hat.
Z.B. zerfällt Kochsalz (NaCl) im Wasser in Na- und Cl+, wobei das Chlor sein
einziges Elektron der äußeren Schale an das Na- Atom abgibt, das dann eine Edelgaskonfiguration auf seiner äußeren Schale hat.
|
| Galvanische Elemente bestehen aus: Behälter aus einem elektrisch isolierendem Material Elektrolyt 2 verschiedenen elektrisch leitenden Stäben (Elektroden) |
| Primärelemente sind solche speziellen Galvanischen Elemente, die unmittelbar, ohne erst geladen werden zu müssen, elektrische Energie abgeben können. Der Nachteil dieser Primärelemnte ist jedoch, dass der elektrochemische Prozess irreversibel (nicht umkehrbar) ist, und die Elemente, nachdem sie einmal entladen wurden, nicht mit einem Ladegerät einfach geladen werden können. |
| Sekundärelemente sind solche speziellen Galvanischen Elemente, bei denen der elektrochemische Prozess bei der Entladung reversibel (umkehrbar) ist, und die daher nach der Entladung wieder geladen werden können, indem man angepasst Strom aus einem Ladegerät oder einem Generator in sie hineinfließen lässt. |
| Entnimmt man Galvanische Elmenten Strom, so gehen Metallionen in Lösung oder schlagen
sich auf den Elektroden nieder. Das Elektrolyt ändert dadurch seine Konzentration. |
Das bekannteste Galvanische Elment ist wahrscheinlich die Zink-Kohle Batterie (1,5V), wie sie in vielen Kleingeräten genutzt wird. |
Galvanische Elemente entstehen auch überall da, wo zwei unterschiedliche Metalle durch Regen oder Salzwasser
Kontakt haben |
Der italienische Anatom Luigi Galvani (1737-1798) liess seinerzeit die Froschschenkel zucken. |
Im Kraftfahrzeug spielen Galvanische Elemente eine Rolle bei: |
Galvanische Elemente |
Elektrochemische Spannungsreihe |
Seitenende |
Nr | Material | Normalpotenzial (V) |
| 1 | Lithium | -3,2 |
| 2 | Kalium | -2,92 |
| 3 | Natrium | -2,71 |
| 4 | Magnesium | -2,35 |
| 5 | Zink | -0,762 |
| 6 | Chrom (2-wertig) | -0,56 |
| 7 | Eisen (2-wertig) | -0,44 |
| 8 | Kadmium | -0,402 |
| 9 | Kobalt | -0,268 |
| 10 | Nickel | -0,25 |
| 11 | Blei | -0,126 |
| 12 | Zinn | -0,14 |
| 13 | Eisen ( 3-wertig) | -0,4 |
| 14 | Wasserstoff | 0 |
| 15 | Kupfer(2-wertig) | +0 34 |
| 16 | Kohle | +0,74 |
| 17 | Silber | +0,81 |
| 18 | Quecksilber | +0,85 |
| 18 | Platin | +1,2 |
| 19 | Gold | +1,5 |
Beispiel:
Zink hat gegen Wasserstoff ein Potenzial (eine Spannung) von - 0,76V
Kohle hat gegenüber Wasserstoff ein Potenzial von + 0,76V
Kohle hat also gegen Zink eine Spannung von 0,76V - (-0,74V)= 15V
Zink-Kohle-Elemente sind die handelsüblichen Kleingerätebatterien, wo
die Mittelelektrode aus Kohle den Pluspol bildet und der Zinkbecher den Minuspol.
der Elektrolyt Braunstein ist.
der Zinkbecher ist das unedlere Material und zersetzt sich bei der Entladung.
Beispiel:
Je geringer das Normalpotenzial des Werkstoffs ist
desto unedler ist er.
 |
Quickstart |  |
 |
 |
 |
 |
Seite:81 |